Ursprünglich war Kowalenko wegen einer Kriegsverletzung in die Medizinische Hochschule Hannover (MHH) gekommen. Eine Springmine hatte ihn getroffen. Sein linker Oberschenkelknochen war gebrochen, das rechte Schienbein ebenfalls, das Fleisch darüber war zerfetzt von der Explosion. Eine schwere Verletzung, aber etwas anderes machte dem behandelnden Ärzteteam Sorgen: Kowalenko war mit dem Bakterium Klebsiella pneumoniae besiedelt. Das ist – für sich genommen – erst mal nicht weiter ungewöhnlich. Die kleinen Stäbchenbakterien leben in fast jedem menschlichen Darm. Bei dem Ukrainer hatten sich die Bakterien allerdings in einer Wunde an der Hüfte ausgebreitet und dafür gesorgt, dass sich diese schwer entzündete. Dazu kam: Klebsiella pneumoniae, mit dem die Wunde besiedelt war, ist multiresistent. Das bedeutet: Es gibt kaum noch Antibiotika, die gegen den Keim wirken.
Kowalenko hatte Glück. Für ihn gab es ein Antibiotikum, das half. Aber selbstverständlich ist das nicht. Denn Antibiotikaresistenzen nehmen zu. Und wenn es kein passendes Mittel gibt, endet eine Infektion mit multiresistenten Erregern oft tödlich. Antibiotikaresistenz ist eine der häufigsten Todesursachen weltweit. 2019 starben 1,27 Millionen Menschen deswegen. Das ist das Ergebnis einer umfangreichen Studie, die im Januar 2022 im Wissenschaftsmagazin "The Lancet" veröffentlicht wurde. Die Weltgesundheitsorganisation (WHO) sagt sogar: Antimikrobielle Resistenz ist eine der zehn größten globalen Bedrohungen für die Menschheit.
Und das ist erst der Anfang: Jüngere Untersuchungen zeigen zudem, dass der Klimawandel die Entstehung von multiresistenten Keimen begünstigt, berichtet das Robert Koch-Institut (RKI) in einer aktuellen Studie (2023). Je höher die Umgebungstemperatur werde, desto höher seien die Antibiotikaresistenzraten und das Infektions- und Verbreitungsrisiko mit multiresistenten Erregern. Das heißt: Man infiziert sich häufiger und die Erreger sind mit höherer Wahrscheinlichkeit sehr resistent gegen Antibiotika. Keine gute Prognose. Fachleute wie Annette Hennigs vom Universitätsklinikum Hamburg-Eppendorf sprechen bereits jetzt von einem Post-Antibiotika-Zeitalter. Das wäre ein Schreckensszenario, denn erst Antibiotika haben dafür gesorgt, dass viele bakteriellen Infektionen meist eher Bagatellen sind. Gäbe es tatsächlich irgendwann keine wirksamen Antibiotika mehr, könnten selbst kleine Infektionen wie eine Blasenentzündung tödlich enden. Die WHO prognostizierte sogar einmal, ohne Antibiotika wäre die Welt wieder so wie vor deren Entdeckung 1928.
Wie konnte es so weit kommen? Ein zentraler Grund ist der inflationäre Gebrauch: "Jahrelang haben Medizinerinnen und Mediziner Antibiotika sehr unkritisch verschrieben", sagt Ella Ebadi. "Bei Erhöhung von Entzündungswerten gab es direkt ein Breitbandantibiotikum, das oft auch noch lange eingenommen werden sollte." Die Ärztin ist an der MHH unter anderem dafür zuständig, dass Hygienemaßnahmen eingehalten werden – ein wichtiger Baustein, damit es gar nicht erst zu Infektionen kommt.
Meist werden Antibiotika bei Atemwegsinfekten verschrieben. Dabei werden die meisten dieser Erkrankungen durch Viren verursacht. Antibiotika helfen jedoch nur gegen Bakterien. "Viele Ärztinnen und Ärzte dachten, Patientinnen und Patienten wollen immer Antibiotika", sagt Ebadi. "Aktuelle Studien zeigen, dass das nicht der Fall ist: Betroffene erwarten Aufklärung und Therapie – aber keine Antibiotikabehandlung, wenn sie nicht nötig ist."
Denn je mehr Antibiotika, desto mehr Resistenzen. Das wusste schon der britische Mediziner Alexander Fleming, der Ende der 1920er-Jahre das erste Antibiotikum Penicillin entdeckte. "Es besteht die Gefahr, dass die Mikroben lernen, resistent gegen Penicillin zu werden", warnte er in seiner Nobelpreisrede 1945. "Der erste Patient ist dann durch seinen gedankenlosen Umgang mit Penicillin möglicherweise verantwortlich für den Tod seines besten Freundes."
Das liegt daran, dass Antibiotika gegen alle Bakterien wirken – auch gegen die, die keine Infektion verursachen. Wenn man Antibiotika einnimmt, entsteht für resistente Erreger ein Selektionsvorteil. Diese können sich dann sehr schnell vermehren, dabei können weitere Resistenzen entstehen. Das bedeutet: Man kann schwer krank werden. So schwer, dass man sterben kann. Insbesondere, wenn das Immunsystem ohnehin geschwächt ist, wie beispielsweise nach Transplantationen. Resistenzen entstehen meist in Kliniken oder in der Massentierhaltung, wo Behandelnde viel und lange Antibiotika verabreichen.
Damit das Problem nicht immer größer und größer wird, hat das RKI verschiedene Schutzmaßnahmen, sogenannte Surveillance-Systeme, etabliert. Mit ihnen soll der Einsatz von Antibiotika und deren Resistenzentwicklung überwacht werden. Eines davon ist das Antibiotic Stewardchip-Team (ABS). Dieses Team ist so etwas wie die schnelle Eingreiftruppe, wenn es um die "richtige" Antibiotikatherapie geht. "Richtig" heißt: So viel wie nötig, so wenig wie möglich. Also der "rationale und verantwortungsvolle Einsatz" des Wirkstoffs, wie es das RKI beschreibt. An vielen Kliniken sind ABS-Teams mittlerweile Standard. Sie sind eines der effektivsten Mittel gegen multiresistente Keime. Denn je genauer Antibiotika eingesetzt werden, desto weniger Resistenzen entstehen.
An der MHH leitet Jessica Rademacher das ABS-Team. Mit schnellen, weiten Schritten geht sie den hellen Flur entlang. Dann links durch die Tür, die Treppen hoch, den Fahrstuhl ignoriert sie. Sie redet, ohne außer Atem zu kommen. Es ist Donnerstag, kurz vor 10 Uhr, Station 23, Gebäude K6, Klinik für Pneumologie und Infektiologie. Gleich beginnt einer der wichtigsten Termine der Woche: die ABS-Visite. ABS-Visite – das heißt im Grunde Fallbesprechung. Nicht irgendwelche Fälle, sondern die, bei denen die behandelnden Ärztinnen und Ärzte nicht weiter wissen und den Rat eines Facharztes brauchen. Als Rademacher den Besprechungsraum betritt, warten der Stationsarzt und ein Mikrobiologe bereits auf sie.
Kaum hat sie sich gesetzt, geht es Schlag auf Schlag: "Patientin ist über die Notaufnahme gekommen, ist lungentransplantiert, hat an der Dialyse gefiebert mit über 38 Grad Celsius und Schüttelfrost", sagt Stationsarzt Janis Casper. "Bekannte chronische Pseudomonas-aeruginosa-Infektion." "Welches Antibiotikum haben Sie ihm gegeben?", fragt Rademacher. "Nach Rücksprache mit dem pneumologischen Oberarzt Meropenem", sagt Casper. Rademacher nickt. "Gute Entscheidung", sagt sie und schaut Mikrobiologe Ralf Vonberg an. "Völlig richtig", stimmt er zu. "Meropenem ist häufig wirksam beim Pseudomonas. Durch die Transplantation ist der Patient schwer immunsupprimiert. Wenn das Antibiogramm da ist, können wir gegebenenfalls deeskalieren."
Zügig gehen die Expertinnen und Experten die Details rund um Infektion und Patientin durch. Wie viel Gramm Antibiotika? Wie lange? Welche Komplikationen können sich ergeben? Von wo kam der Abstrich? Ist der Keim überhaupt der, der die Infektion verursacht? Es ist ein routinierte Abfolge von Fragen und Antworten, die nur wenige Minuten dauert. "Im ABS-Team ist es manchmal wie Detektivarbeit, es gibt immer wieder faszinierende Fälle", sagt Rademacher später und lächelt. "Die Arbeit hört nie auf. Das ist unglaublich spannend. Dazu ist dieser Bereich immer in Bewegung, weil laufend neue Resistenzen entstehen."
Es ist eine verantwortungsvolle Aufgabe, die nicht aufhören darf, weil sie Leben rettet. Und sie beginnt schon viel früher. Denn bevor Menschen in der MHH aufgenommen werden, werden sie gescreent. Das bedeutet: Sie werden auf multiresistente Keime getestet. "Menschen sind besiedelt mit multiresistenten Erregern. Das tut nicht weh, das merken wir gar nicht", erklärt Ella Ebadi. "Erst durch invasive Maßnahmen wie eine Operation kann uns dieser Keim krank machen. Zum Beispiel wenn er von der Nase in eine Wunde gelangt." Der multiresistente Krankenhauskeim wird regelmäßig in die Klinik mitgebracht und wird dort zum Problem.
Spätestens wenn das passiert, kommt Ralf Vonberg ins Spiel. Er ist Facharzt für Mikrobiologie, Virologie und Infektionsepidemiologie an der MHH. Rund 700 Proben untersuchen er und sein Team jeden Tag im Labor. Nicht nur für die MHH – auch andere Kliniken schicken Abstriche von eitrigen Wunden oder Blut, wenn sie vermuten, dass Bakterien eine Infektion verursachen. Vonberg und sein Team ermitteln dann, ob es einen Keim in den Abstrichen gibt, welcher es ist – und ob dieser multiresistent ist.
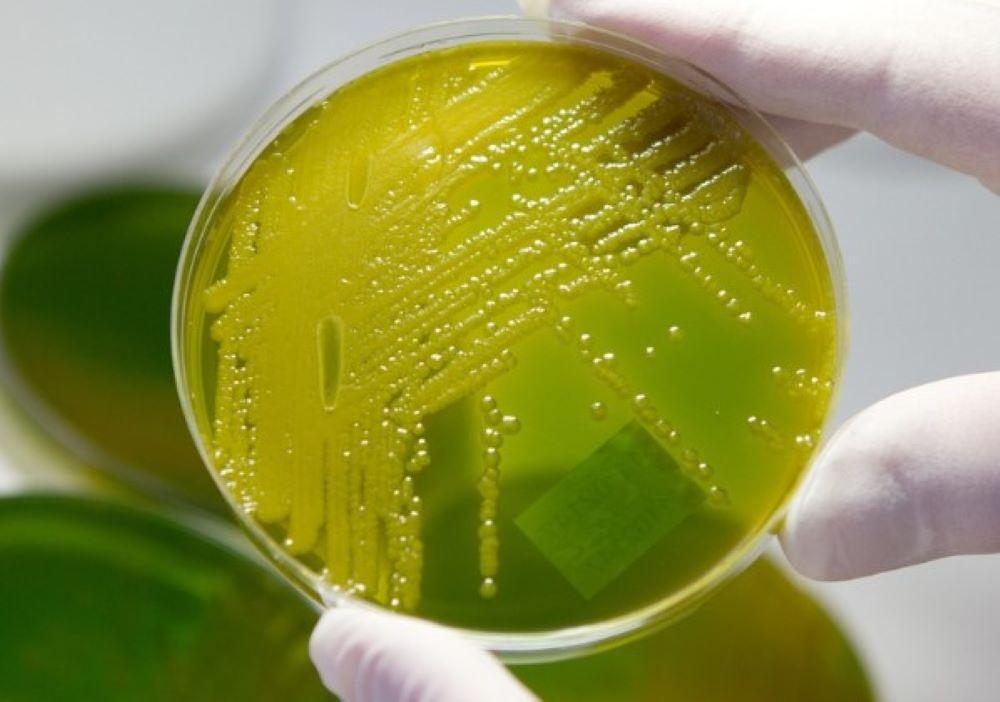
Jede Probe, die im Labor ankommt, kommt zunächst auf eines der roten, wackelpuddingartigen Nährmedien und verbringt die Nacht in einem metallenen Brutschrank. "Bakterien verdoppeln sich im Schnitt alle 20 Minuten", erklärt Vonberg und hält eines der Nährmedien hoch. In der Mitte sind blaue Streifen und Punkte zu erkennen. "Hier kann man sehen, dass über Nacht Bakterienkulturen gewachsen sind", sagt er. Welche das sind und ob der Keim multiresistent ist, wird allerdings erst durch die Massenspektrometrie und die Empfindlichkeitsprüfung klar.
Und die ist komplizierter, als man denkt: "Nicht jeder Bakterienstamm, der theoretisch multiresistent sein kann, ist auch multiresistent", erklärt Vonberg, der das Buch "Medizinische Mikrobiologie für Dummies" geschrieben hat. Mit Handschuhen kramt er im Mülleimer. "Ich will nichts versprechen, aber …", sagt er, zieht eine dünne Plastikkarte aus dem Behälter, "… wir haben Glück!" und deutet auf die kleinen Fenster auf der Karte. "Hinter jedem dieser Fenster ist eine kleine Kammer mit verschiedenen Antibiotika in unterschiedlicher Konzentration", sagt Vonberg. "Wenn die Bakterien resistent sind, trübt sich die Kammer."
Anhand dieser Karte wird ein sogenanntes Resistogramm erstellt. Mit Resistogramm oder Antibiogramm ist der mikrobiologische Nachweis der Empfindlichkeit eines Bakterienstamms gegen bestimmte Antibiotika gemeint. Es zeigt, welche Antibiotika noch gegen das Bakterium wirken und welche nicht. Das kann man den Karten jedoch nicht direkt ansehen, daher errechnet ein Programm, ob der Keim multiresistent ist.
"Es kann sein, dass fast alle Kammern trüb sind und der Keim trotzdem nicht multiresistent ist", sagt Vonberg. "Aber wenn die ausschlaggebenden Kammern trüb sind, und wenn es auch nur zwei sind, dann kann er multiresistent sein." Das Ergebnis wird vom Labor an die behandelnden Ärztinnen und Ärzte weitergegeben. Erst dann kann das am besten passende Antibiotikum ausgewählt werden.
Was ist, wenn es keines mehr gibt, das noch wirkt? "Wir hatten es schon mehrfach, dass keine Antibiotika mehr geholfen haben", sagt Vonberg. "Diese Patientinnen und Patienten sind dann nicht mehr therapierbar." Sie können sterben, wenn sie eine schwere Infektion mit diesen Bakterien erleiden. "Das sind bislang nur Einzelfälle", sagt er. "Aber diese Fälle hat es vor zehn Jahren noch nicht gegeben." Dazu kommt, dass sich die Resistenzentwicklung gerade abermals verschärft. Der Grund: der Krieg in der Ukraine. Abgesehen von den Lieferkettenproblemen der Antibiotika, schafft der Krieg auch optimale Bedingungen für besonders multiresistente Keime. Das liegt insbesondere daran, dass es in Kriegsgebieten oft nicht mehr möglich ist, die Hygienestandards einzuhalten.
"Die Erreger, die aus Kriegsgebieten mitgebracht werden, sind deutlich resistenter als die, die wir hier in Deutschland in der Regel vorfinden", erklärt Oberärztin Rademacher. "Ich habe hier Resistogramme einiger Patientinnen und Patienten aus der Ukraine gesehen, die mir durchaus Sorge bereiten. Da sieht man, dass fast alle Antibiotika, die wir zur Verfügung haben, nicht wirken."
Ein drängendes Problem – nicht nur in deutschen Kliniken. Forschende der Universität Lund in Schweden haben die Resistenzentwicklung in der Ukraine untersucht und festgestellt: Eine "alarmierend hohe Zahl von Proben" enthielt Bakterien, die gegen alle gängigen Antibiotika resistent waren. Das Ausmaß dieser Situation übersteige "alles, was wir bisher gesehen haben", sagt Kristian Riesbeck, ein Autor der Studie und Professor für klinische Bakteriologie an der Universität Lund. Er warnt: "Es besteht die Gefahr einer weiteren Ausbreitung resistenter Bakterien, die den gesamten europäischen Raum bedroht."
Es gibt Versuche, alternative Mittel zu entwickeln, die wie Antibiotika wirken, aber weniger Resistenzen hervorrufen. Ein prominentes Beispiel sind die Bakteriophagen. Dabei handelt es sich um Viren, die Bakterien infizieren und töten. Im Gegensatz zu Antibiotika greifen sie jedoch nicht alle, sondern jeweils nur einen Bakterienstamm oder wenige Stämme an. Vereinzelt werden Bakteriophagen in den USA und in Georgien, aber auch im Bundeswehrkrankenhaus in Berlin gegen Atemwegsinfektionen oder infizierte Wunden eingesetzt, berichtet das Science Media Center.
Diese Art von Therapie steckt in Deutschland noch in ihren Anfängen. Es gibt noch zu wenige Studien, die die Wirksamkeit beweisen. Es ist, wie Rademacher es beschreibt, ein "individueller Heilversuch". Das bedeutet: Phagentherapien sind nur für wenige Betroffene sinnvoll und auch nur bei ganz speziellen Infektionen.
Antibiotika bleiben also die Mittel der Wahl. Eine Resistenzkrise lässt sich nur durch neue Antibiotika stoppen. Doch die Antibiotikaentwicklung ist langwierig und kostspielig. Seit 2017 sind gerade einmal zwölf Antibiotika zugelassen worden. Zehn davon basieren auf etablierten Mechanismen. "Wenn wir in fünf Jahren neue Substanzen auf dem Markt wollen, dann müssen wir heute anfangen, sie zu entwickeln", sagt Rademacher. "Sonst stehen wir irgendwann mit dem Rücken zur Wand. Bei Einzelfällen ist das auch heute schon so, und das macht mir Sorgen."
ag/pcl




